Jak naprawiać mitochondria i hamować starzenie w zespole Downa.
maj 14, 2020 by Jarek
Kategoria: Metabolizm
Dysfunkcyjne mitochondria to szybsze starzenie i jest to jednoznacznie proste do zrozumienia w układzie konsekwencji. Można też tak powiedzieć: nie mam siły by przejść, oznacza to że umieram. Trudne ale precyzyjne.
Jeżeli chcecie zrozumieć tą tematykę lepiej proponuję zacząć od cyklu poświęconego mitochondriom tutaj:
http://www.zespoldowna.info/zaburzenia-mitochondriow-w-zespole-downa-cz-1-geny-z-21-chromosomu.html
http://www.zespoldowna.info/zaburzenia-mitochondriow-w-zespole-downa-cz-4-wyjasnienia-genow-zd.html
http://www.zespoldowna.info/zaburzenia-mitochondriow-w-zespole-downa-cz-9-jakie-suplementy.html
http://www.zespoldowna.info/zaburzenia-mitochondriow-w-zespole-downa-cz-11-d-ryboza.html
Dla mnie to niezwykłe, że mam podsumowanie moich pojedynczych wpisów dzisiaj w postaci jednego wspaniałego, fachowego raportu medycznego, potwierdzającego wcześniejsze cząstkowe tezy.
https://www.mdpi.com/1422-0067/21/9/3134/htm
Zatem pojawił się nowy raport opisujący zależności w funkcjonowaniu mitochondriów w zespole Downa. Krytyczne zdanie w raporcie wokół którego wszystko niejako się obraca to:
Spadek jakości funkcjonowania mitochondriów, będący efektem zmienionej organizacja strukturalnej i funkcjonalnej mitochondriów, zaobserwowano w zespole Downa (DS), a także w starzeniu się i patologiach związanych z wiekiem.
Zatem raport jest precyzyjnie ukierunkowany na dysfunkcję mitochondriów, co prowadzi do przyspieszonego starzenia się. Głównym celem tej analizy jest zaprezentowanie szczególnego mechanizmu w ZD:
Upośledzona aktywność koaktywatora transkrypcji PGC-1α / PPARGC1A i hiperaktywacja kinazy rapamycyny (mTOR) ujawniają się jako molekularne przyczyny tych mitochondrialnych zmian.
Wnioski z tej analizy mają przede wszystkim wskazać jak stymulować aktywność PGC-1α i wyhamować mTOR, by odwrócić dysfunkcję mitochondriów.
Zanim przejdziemy dalej trochę wiedzy.
1.NRIP1 a PGC-1α.
NRIP1 jest potrojonym genem z 21 chromosomu mający istotny wpływ na funkcjonowanie mitochondriów w tym nagen PGC-1α, o czym wszyscy którzy brali udział w szkoleniu na ten temat wiedzą i to w jednym paluszku ![]()
“W ZD kluczową rolę w metabolizmie mitochondriów, odgrywa gen nazywany NRIP1, jest on potrojony, gdyż znajduje się na 21 chromosomie. PGC-1α kluczowy gen dla odpowiedniego funkcjonowania mitochondriów jest zależny od potrojonego w ZD genu NRIP1! Jest też zależny od stabilnego działania genów DYRK1A i RCAN1.”
“Aktywność NRIP1 na szlakach mitochondrialnych prezentowany jest głównie poprzez represyjną kontrolę nad koaktywatorem transkrypcyjnym PGC-1α i jego celami (Scarpulla 2011), w tym czynnikami transkrypcyjnymi NRF1, ERRα, PPAR, które są tłumione przez NRIP1 i indukowane przez PGC-1α w dawce sposób zależny (Chen i in. 2012). Rodzina genów receptorów jądrowych PPAR składa się z trzech izoform: PPAR-α, PPAR-β / δ i PPAR-γ wyrażanych w różnych tkankach, które indukują ekspresję genów poprzez specyficzną interakcję z czynnikami transkrypcyjnymi.”
No właśnie z tego trudnego zdania wynika inny fakt: im bardziej aktywny jest NRIP1 tym bardziej wyhamowany jest gen PGC-1α będący jego antagonistą z jednej strony, z drugiej będący kluczowym regulatorem funkcjonowania mitochondriów.”
http://www.zespoldowna.info/zaburzenia-mitochondriow-w-zespole-downa-cz-4-wyjasnienia-genow-zd.html
http://www.zespoldowna.info/nowy-panel-mthfr-uk-cz-3-detoksykacja-i-mitochondria.html
2.mTOR w zespole Downa.
“mTOR jest nadaktywny w zespole Downa. mTOR tutaj jest traktowany jako regulator rozwoju i starzenia się komórki. Ta deregulacja mTOR wpływa na rozwój hipokampu tak istotnego elementu w mózgu człowieka, który w ZD w sposób istotny jest inny niż u grup rówieśniczych. Wskazuje się tutaj na problem rozwoju synaps i aksonów, których połączenia stają się mniej aktywne.”
http://www.zespoldowna.info/jak-wplywa-autyzm-na-zespol-downa-cz-2-mtor.html
Wracamy do raportu. Powtórzę jeszcze raz jego bazą są NAUKOWO UDOWODNIONE zjawiska opisane następująco:
“Zespół Downa (ZD) i starzenie mają zaburzone funkcjonowanie mitochondriów, objawiające się spadkiem biogenezy i rotacją mitochondriów [23, 23, 25, 26]. W komórkach trisomicznych zaobserwowano istotne rozdrobnienie sieci mitochondrialnej [24] i nagromadzenie uszkodzonych mitochondriów [27]. Podczas starzenia utrata równowagi między biogenezą a rotacją prowadzi do kumulacji mutacji w mitochondrialnym DNA (mtDNA) i powoduje wzrost liczby uszkodzonych mitochondriów [28].”
Z tej perspektywy musimy włączyć jeszcze jeden kawałek wiedzy dotyczący genu RCAN1 i DRP1 wskazujący na fakt jak istotne jest zaburzenie architektury mitochondriów tytułem dodatkowego 21 chromosomu:
“RCAN1 dodatkowo jednak jest związany z nadmiernym stresem oksydacyjnym, dysfunkcją mitochondriów tytułem nadmiernej ilości jonów wapnia zatykających je oraz dewastacją membran i ich przepuszczalności. Nadmierna aktywność RCAN1 zmienia jakość funkcjonowania genu DNM1L, regulującego funkcjonowanie białka Drp1. Jest ono krytyczne dla fragmentacji, przeżywalności i utrzymania aktywności mitochondriów w komórkach.”
http://www.zespoldowna.info/zaburzenia-mitochondriow-w-zespole-downa-cz-4-wyjasnienia-genow-zd.html
Jak czytamy w raporcie:
“DRP1 odgrywa centralną rolę w rozszczepieniu mitochondriów [32], prawdopodobnie wchodząc w interakcje z białkiem FIS1, białkiem zewnętrznej błony mitochondrialnej [30,33]. Mutacje lub utrata białek rozszczepialnych blokują podział mitochondriów, przesuwając równowagę w kierunku fuzji [32,34]”
Oznacza to zatem, że architektura mitochondriów jest pod dużym wpływem genu RCAN1 i tylko jego inhibicja może prowadzić do równowagi, poprzez regulowanie aktywności genu DRP1. Do tego dochodzą 3 kolejne geny jak OPA1, MFN1, MFN2 wpływające na zewnętrzne błony mitochondrialne. W efekcie nie tylko sama struktura mitochondriów, ale i ich błony ulegają zmianom, ograniczając wydolność mitochondriów tytułem zmiany ich budowy.
Autorzy raportu na tym wykresie świetnie zaprezentowali kwestie równowagi między biogenezą a mitofagią. Biogeneza to powstawanie, tworzenie się, gdy mitofagia jest to proces selektywnego usuwania wadliwych mitochondriów w procesie autofagii
http://naukawpolsce.pap.pl/aktualnosci/news%2C411429%2Cbadaczka-autofagia-ma-dwie-twarze.html
Opisują ten proces w następujący sposób:
“Homeostaza mitochondrialna opiera się na zrównoważonej grze między biogenezą a mitofagią. Po lewej stronie przedstawiono niektóre molekularne mechanizmy biogenezy mitochondrialnej. Współaktywator receptora γ aktywowany przez proliferator peroksysomów (PGC-1α) indukuje ekspresję jądrowego czynnika oddechowego 1 (NRF1), który reguluje większość genów mitochondrialnych kodowanych jądrowo (NEMG) i czynnika transkrypcyjnego A (TFAM) , który rządzi mitochondrialnym DNA (mtDNA). Po prawej stronie przedstawiono niektóre aspekty procesu mitofagii. Ssacki cel sygnalizacji rapamycyny (mTOR) negatywnie reguluje usuwanie uszkodzonych mitochondriów przez szlak zależny od domniemanej kinazy 1 indukowanej PTEN (PINK1) i ligazy białkowej ubikwityny białkowej RBR E3 (PARKIN). LC3 promuje tworzenie autofagosomów.”
Istotną konkluzją z tego opisu jest fakt, że czynniki hamujące działanie PGC-1α powodują brak równowagi z przyspieszoną aktywnością mTOR.
http://www.zespoldowna.info/zaburzenia-mitochondriow-w-zespole-downa-cz-4-wyjasnienia-genow-zd.html
Jakie są to czynniki hamujące? Znów posłużę się diagramem z raportu, który pokazuje jak 21 dodatkowy chromosom wyhamowuje PGC-1α .
Geny wylistowane po prawej stronie są krytyczne w tym rozważaniu czyli: NRIP1, APP, RCAN1, DYRK1A, PREP1.
Po drugiej stronie mamy wyhamowaną autofagię, tytułem przyspieszenia mTOR. To wszystko wpływa na starzenie się poprzez dysfunkcję architektury i efektywności mitochondriów. Zdjęcia publikowane w raporcie są dość precyzyjne, poniżej.
https://www.mdpi.com/1422-0067/21/9/3134/htm
Komórka trisomiczna to ta po prawej stronie. Im starsza jest osoba z ZD, tym te procesy są bardziej dysfunkcyjne.
Pierwszym rozwiązaniem tych wszystkich problemów jest metformina hamująca mTOR i aktywizująca PGC-1α. Autorzy tak to zaprezentowali:
Chcę tutaj nadmienić, że metformina jest po projektach klinicznych potwierdzających jej efektywność na tym szlaku. Z drugiej strony wciąż trwają dyskusję jak metformina wpływa w ZD na ilość siarkowodoru, co nie musi być procesem korzystnym…ale wciąż nie ma jednoznacznych badań w tym temacie w ZD.
http://www.zespoldowna.info/metformina-uzywac-czy-nie-uzywac.html
Kolejnym wsparciem w tym zakresie jest AMPK oraz pioglitazon, tudzież resweratrol trans czy EGCG.
Kolejną propozycją o której tez już pisałem wcześniej jest urolityna A, “metabolit wytwarzany przez bakterie jelitowe z polifenoli granatów i jagód, może spowalniać związany ze starzeniem proces utraty siły i spadku masy mięśniowej. Dzieje się tak, bo UroA wywiera korzystny wpływ na "fabryki" energetyczne komórek – mitochondria.”
Działanie wspomnianych substancji w sposób kluczowy aktywizuje PGC-1α.
https://en.wikipedia.org/wiki/Urolithin_A
https://kopalniawiedzy.pl/granat-truskawki-urolityna-A-UroA-metabolit-mitochondria-biogeneza,30250
Ja dodam od siebie, że taką substancją jest też PQQ.
http://www.zespoldowna.info/creb-i-pqq.html
“PQQ stymuluje ekspresję PGC-1α poprzez aktywację białka wiążącego element odpowiedzi cAMP (CREB)… Sugeruje to, że zdolność PQQ do regulacji biogenezy mitochondrialnej zachodzi poprzez stymulację szlaku CREB-PGC-1alfa i dostarcza dowodów na to, jak niewielki składnik diety może poprawić funkcję mitochondriów”.
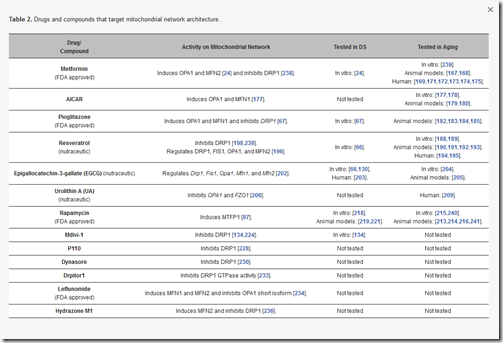
Jeżeli regulujemy biogenezę, teraz konieczna jest regulacja mTOR. Do tego służy chociażby rapamycin lek zatwierdzony w USA przez FDA. Jednak zarówno aktywizacja PGC-1α, jak regulacja mTOR to za mało, by architektura mitochondriów była właściwa. Naukowcy zaproponowali cały szereg leków, w tym zatwierdzonych już do użycia, które ta kwestię regulują. Możecie je zobaczyć na liście poniżej.
https://www.mdpi.com/1422-0067/21/9/3134/htm
Jest jednak z nimi jeden problem. W zakresie osób z ZD i starzenia nie przeszły one prób klinicznych, choć w wielu przypadkach przeszły przez sito badań kierunkowych.
Wnioski:
1.Dysfunkcja mitochondriów w ZD istnieje i co rodzic nie widzi okiem dziś, to nie rozumie tego że to istnieje.
2.Dysfunkcja mitochondriów w ZD jest dzisiaj możliwa do leczenia.
3.Jest to problem krytyczny i nie można zaprzeczać że go nie ma, bo jest.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6016872/
https://www.hindawi.com/journals/cggr/2012/383170/
https://www.nature.com/articles/s41598-018-20834-y#MOESM3
2.Mamy zestaw