Zaburzenia mitochondriów w zespole Downa cz.12 stres oksydacyjny w ZD i w autyzmie ŁĄCZNIE
grudzień 12, 2019 by Jarek
Kategoria: Metabolizm
Na koniec cyklu pojawia się jeden bardzo istotny i skomplikowany problem jaki mamy w przypadku mitochondriów. Co z nimi gdy mamy dziecko z ZD i autyzmem łącznie?!
Podstawową wiedzę o mitochondriach w zespole Downa znajdziecie tutaj:
http://www.zespoldowna.info/zaburzenia-mitochondriow-w-zespole-downa-cz-4-wyjasnienia-genow-zd.html
Co z autyzmem? Wracamy do badań dr.Jill James która zaprezentowała przełomowe badania nad metylacją i stresem oksydacyjnym w ZD (tutaj ją “olano”) i w autyzmie (tutaj została okrzyknięta przełomowym odkrywcą).
https://academic.oup.com/ajcn/article/80/6/1611/4690493?wptouch_preview_theme=enabled
O jej badaniach pisałem na stronie i po te dane teraz sięgniemy.
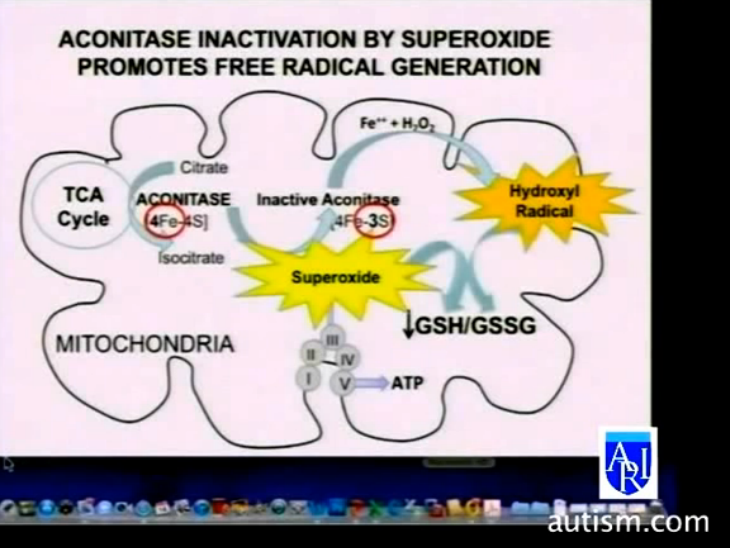

“Analizując oba diagramy widzimy duże podobieństwo problemów, choć wywoływane są one często innymi mechanizmami. Dla obu diagnoz wspólny jest wpływ mutacji genu MTHFR. Odmienny wpływ genu CBS i często TCN na cykl kwasu foliowego w ZD. Wpływają one na określoną ilość witaminy B 12 w cyklu. Z kolei w autyzmie gen RFC 1 może powodować obniżenie dostępnej w cyklu ilości kwasu foliowego.
Biorąc pod uwagę nadekspresję genów typowych dla ZD tj.: CBS, GART, FTCD mamy do czynienia w cyklu kwasu foliowego z istotnym zmniejszeniem się grup metylowych. Homocysteina jest na bardzo niskim poziomie, chyba że mamy mutację genu MTHFR i wtedy wszystko jest poprzewracane do góry nogami.
http://www.zespoldowna.info/zrozumiec-sam-i-kwas-foliowy.html
RFC 1 (SLC19A1 inna nazwa). Temat tego genu jest bardzo ciekawy. W autyzmie mów się o braku kwasu foliowego tytułem spadku ekspresji tego genu o 16%, zatem jego gorszego funkcjonowania. W przypadku ZD mamy do czynienia z ilościowym zmniejszeniem się tego nośnika kwasu foliowego, którego gen znajduje się na 21 chromosomie, co wpływa na brak równowagi między cyklami SAM i kwasu foliowego!!! Jednakże one MUSZĄ SIĘ KOMPENSOWAĆ RÓWNOWAŻYĆ, BY BYĆ efektywnym.
3.Cykl SAM
W ZD ta cześć cyklu według profesor Obeidy przejmuje na siebie ciężar dostawcy grup metylowych do metylacji DNA zamiast cyklu kwasu foliowego. http://www.zespoldowna.info/potencjalne-biomarkery-w-zespole-downa-wedlug-profesor-rima-obeid-cz-1.html
Profesor Obeida wskazuje, że taką ścieżką kompensacyjną może być “alternatywna ścieżka donorów grup metylowych” w postaci choliny i betain, które mogą dostarczać grupy metylowe całkowicie niezależnie od cyklu kwasu foliowego. Obie te grupy mogą być suplementowane poprzez odpowiednią dietę lub podawanie odpowiednich preparatów wpływając na poziom dostarczanej metioniny i SAM (często nazywane w przypadku dietetycznym jako SAMe). Jak wskazuje w swoich badaniach, tak właśnie organizm z ZD postępuje, kompensuje sobie na ile jest to możliwe ograniczenia cyklu kwasu foliowego…o ile pomoże w tym dieta.
W autyzmie, sytuacja jest podobna, o tyle że organizm potrzebuje cyklu kwasu foliowego, za wszelką cenę.
http://ajcn.nutrition.org/content/91/6/1598.full
3.Detoksykacja.
W ZD kluczowym problemem tego procesu jest nadekspresja genu SOD, bardzo istotna. Zakłócenia przez ten fakt są jednoznaczne i cały ten cykl w ZD źle funkcjonuje wytwarzając istotne ilości wolnych rodników i nadtlenku wodoru. Suplementowanie procesu metylacji poprzez dodanie betain i kwasu foliowego w odpowiedniej formie w ZD normalizuje pracę tych procesów na tym etapie cyklów.
W autyzmie problem GSH glutationów zredukowanych do GSSG glutationów utlenionych pokazuje status trwania wysokiego poziomu stresu tlenowego, który wywołuje silny stan zapalny i uszkodzenie DNA. Z tej perspektywy detoksykacja w autyzmie jest kluczowym czynnikiem trudnym do zrównoważenia. Można ją minimalizować poprzez suplementację kwasem foliowym o odpowiedniej formulacji. Dzięki temu kolejny etap leczenia jest zdecydowanie bardziej efektywny i łatwiejszy w działaniu.”
Tak opisywałem różnice w metylacji w ZD i autyzmie wiele lat temu. Dzisiejsza wiedza wciąż na tym operuje.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4001006/
“Wyjściowe stężenia metabolitów w cyklu metioninowym i na szlaku transsulfuracji były znacząco różne między dziećmi z autyzmem i dziećmi z grupy kontrolnej. W cyklu metioninowym stężenia metioniny, SAM i homocysteiny w osoczu były znacznie niższe, a stężenia SAH i adenozyny były znacznie wyższe niż u dzieci kontrolnych (Tabela 1). Stosunek SAM do SAH był prawie o 50% niższy u dzieci autystycznych niż u dzieci kontrolnych. Znaczące zmniejszenie stężenia cystationiny i cysteiny w osoczu obserwowane u dzieci z autyzmem (Tabela 1) było zgodne ze zmniejszeniem transsulfuracja za pośrednictwem CBS. Z niskim średnim stężeniem cysteiny w osoczu związany był znaczący spadek stężenia tGSH. GSSG zwiększono prawie dwukrotnie, a tGSH: GSSG zmniejszono o 70%.”
https://academic.oup.com/ajcn/article/80/6/1611/4690493?wptouch_preview_theme=enabled
W ramach powyższego raportu zastosowano:
“…interwencja z betainą i kwasem folinowym skutecznie doprowadziła wszystkie metabolity z cyklu metioninowego do normalnego zakresu i jednocześnie znacznie poprawiła metabolity na szlaku transsulfuracji.”
Podsumowujemy teorię stresu oksydacyjnego w autyzmie:
1.Wysoki stres oksydacyjny niszczy mitochondria, stąd autyzm jest problemem szczególnie hamującym efektywne ich działanie.
2.Stres oksydacyjny wynika ze złej metylacji w tym źle funkcjonującego genu SLC19A czyli w autyzmie jego ekspresja jest aż o 16% mniejsza, błędów na polimorfizmach genów takich jak MTHF C677T, czy też MTHFD1, czy też receptorami kwasu foliowego o nazwie FRA. Wszystkie te geny są związane z cyklem kwasu foliowego.
3.Niski poziom cysteiny i cystationiny wskazuje na zdecydowane niższe poziomy glutationu istotnego do redukcji stresu tlenowego.
Połączmy to teraz w całość na podstawie modeli dr.Jill James dla ZD i autyzmu.
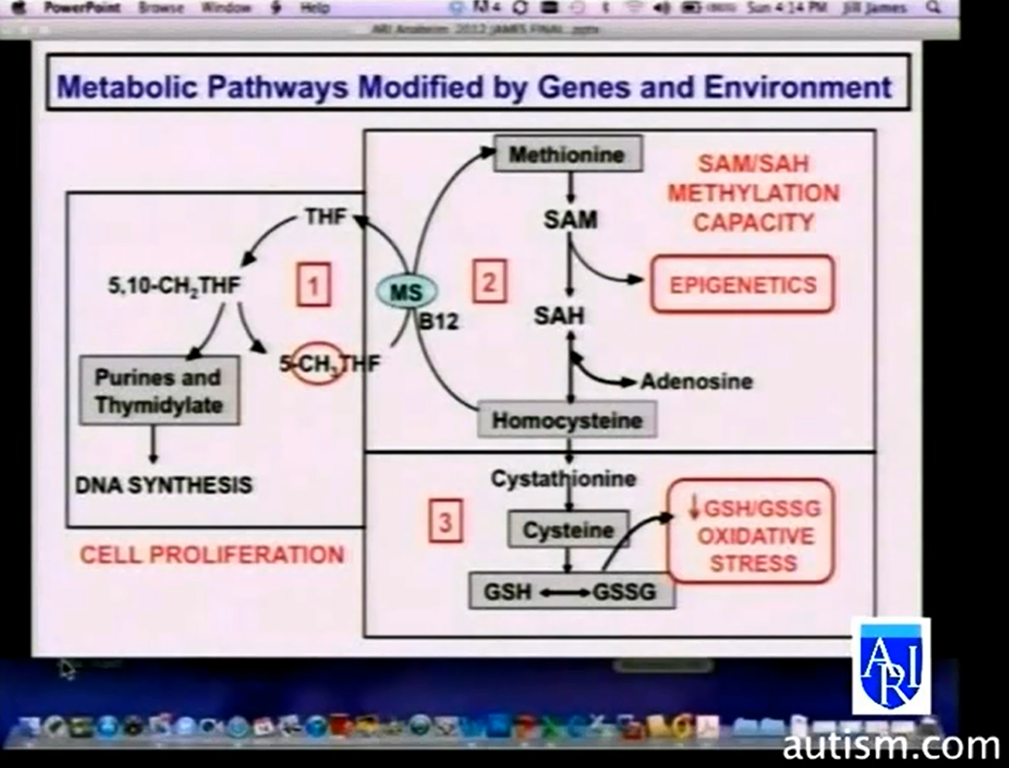
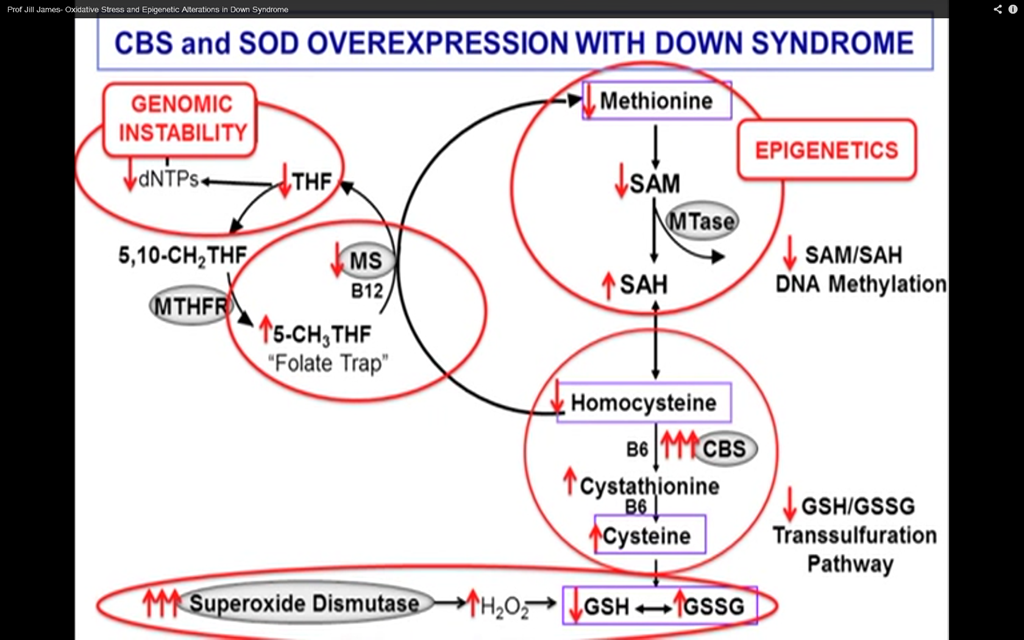
1.W obu przypadkach tytułem zmniejszonej/dostępnej ilości cysteiny do produkcji glutationu, choć z różnych powodów, mamy do czynienia ze zmniejszoną ilością GSH czyli glutationu zredukowanego, jak i glutationu utlenionego.
2.W obu przypadkach mamy do czynienia z błędami na metylacji, w szczególności na poziomie cyklu kwasu foliowego.
3.Jednakże całkowicie inny mamy status genu CBS: w zespole Downa silnie aktywny, potrojony, “podkręcany” genem potrojonym DYRK1A. Świadczy o tym bardzo niska homocysteina (dużo niższy poziom niż w autyzmie), wysoki poziom cysteiny (znacząco wyższy poziom niż w autyzmie).
4.Mamy wysoki poziom ponadtlenku wodoru w ZD tytułem potrojenia genu SOD1 i jego wysokiej ekspresji, gdy w autyzmie mamy problem równowagi między ilością glutationów a ponadtlekiem wodoru. Wynika ten stan z normalnej ilości genów, które są w zdecydowanie innej ekspresji. Stan w autyzmie z “matematycznego” punktu widzenia jest kwestią jedynie zbilansowania tej bezpośredniej relacji i jest zdecydowanie łatwiejsze niż w ZD. W ZD mamy do czynienia z sytuacją, gdzie “populacyjnie” działający układ produkcji glutationu musi przeciwstawić się nadmiernej, bo wynikającej z potrojenia genu SOD1, produkcji ponadtlenku wodoru.
Zatem wracamy do pytania z tytułu, jaki otrzymałem od Was: “Jak poradzić sobie ze stresem tlenowym u dziecka z ZD i autyzmem łącznie?” w kontekście ochrony mitochondriów.
Odpowiedź wydaje się być dość łatwa.
Po pierwsze ZD jest trudniejszym, bardziej powiązanym schematycznie tematem i powinniśmy stosować reguły z ZD.
Po drugie w takim przypadku na pierwszym miejscu jest analiza metabolizmu cysteiny kończąca się poziomem amoniaku. Dlaczego? Może się okazać, że aby leczyć i chronić mitochondria najpierw trzeba zbić poziom amoniaku i wprowadzić apigenin, a dopiero potem poprawiać metylację i ilość glutationu.
Po trzecie w ZD nie możemy stosować tego co jest najprostsze do zastosowania czyli: glutationu, NAC, czy kwasu alfa liponowego ze względu na obecność siarki w tych suplementach, gdy w autyzmie jest to w pewnych uwarunkowaniach właściwe. W naszym przypadku musimy działać w sposób pośredni wprowadzając antyutleniacze jako dodatkowe wsparcie i licząc na efektywne działanie ścieżki detoksykacyjnej z genem NFR2.
Na koniec dopiero podkręcamy metylację, ale z większym naciskiem na skrót metylacyjny.Pozostałe części cyklu dostosowujemy do polimorfizmów i typologii ZD na cyklu kwasu foliowego.


