Zespół Downa i polimorfizmy.
sierpień 7, 2017 by Jarek
Kategoria: MTHFR i inne polimorfizmy
Dostałem taki list z takim pytaniem: “Jarek piszesz o błędach genowych, a czy była opublikowana taka informacja o zespole Downa?”. Postaram się zatem odnieść do tego.
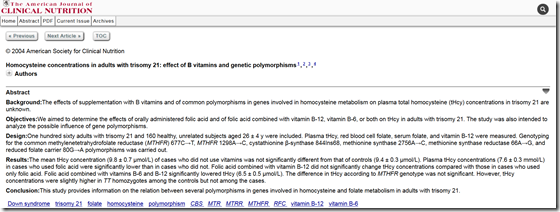
Do 2010 roku jedyną podstawową publikacją w tym zakresie był raport z roku 2004, który analizował polimorfizmy w ZD, co jak na owe czasy było czymś przełomowym i odkrywczym.
http://m.ajcn.nutrition.org/content/80/6/1551.long?view=long&pmid=15585767
Istotna część artykułów, która dotyczy metylacji w zespole Downa opierała się o ten raport, powielając wiele błędów w nim zawartych pomimo postępu, który korygował jego zawartość. Biorąc pod uwagę, jak często przeciwnicy wspierania osób z ZD wykorzystują ten raport postaram się go Wam przybliżyć.
1.JAKIE GENY WYSTEPUJĄ NA 21 CHROMOSOMIE I BIORĄ UDZIAŁ W METYLACJI.
Artykuł, przypominam z 2004 roku, nie miał tych zasobów wiedzy co my mamy dziś, więc widział metylację w ten sposób:
CBS widziany jest jako kluczowy gen istotnie wpływający na “zduszenie” poziomu homocysteiny poprzez jego potrojenie, determinuje całą metylację. CBS przy udziale witaminy B6 w formie P5P, wykorzystuje homocysteinę i serynę, tworząc cystationinę. W badaniach wskazuje się, że polimorfizm CBS T833C jest najczęściej występującym wariantem polimorfizmu w ZD, znacząco aktywizujący ten gen.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1334203/
http://www.nature.com/leu/journal/v16/n11/full/2402705a.html
Nie wskazano jednak czy jego nadmierna aktywność koreluje z większym użyciem witaminy B6 jako kofaktorem, czy też nie.
RFC1 lub SLC19A1 jest to gen odpowiedzialny za transport kwasu foliowego do komórek. Jego potrojenie plus najczęściej występujący polimorfizm RFC 1 A80G “wolny” w istotny sposób zakłóca obecność kwasu foliowego w komórkach, stąd wielokrotnie był analizowany jako element ryzyka czy to urodzenia dziecka z ZD, czy też jego wady serca.
http://www.sciencedirect.com/science/article/pii/S2352081716301039
PODUSMOWANIE:
Badania dr.Mara Diersen mówiące o zdecydowanie zmiennej metylacji w ZD, jak i badania dr.Jill James, czy dr. Rimy Obeidy, publikowane po 2010 roku zdecydowanie zmieniły obraz opisywany w tym raporcie wskazując na pewne istotne szczegóły:
http://www.zespoldowna.info/po-wykladzie-profesor-jill-james-czyli-homocysteina.html
http://www.zespoldowna.info/konferencja-na-malcie-wystapienie-profesor-jill-james-cz-1.html
http://www.zespoldowna.info/analizujemy-metylacje-cz-6-metylacja-czy-acetylacja-w-zespole-downa.html
*Niska homocysteina nie jest efektem przyspieszenia jedynie genu CBS ale i wpływu genu DYRK 1A o czym wcześniej nie wiedziano
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2760102/
*Nie wspomniano tutaj o roli genu DNMT3L nadmiernie metylowanego, którego wpływ na metylację i jej zaburzenie w ostatnich latach jest kluczowym obszarem badań gdyż wykracza poza 21 chromosom, a roku 2004 nie brano go pod uwagę
http://www.zespoldowna.info/egcg-reguluje-funkcjonowanie-genow-z-rodziny-dnmt.html
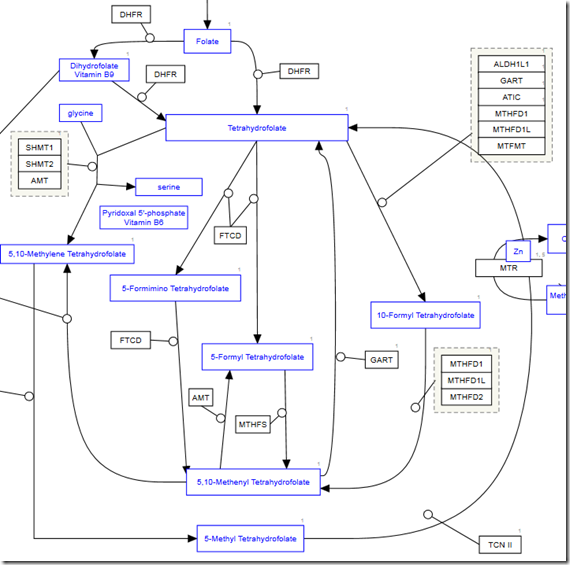
*Nie wspomniano tutaj także o roli genów GART i FTCD związanych z metabolizmem kwasu foliowego, które wpływają na ilość potrzebną kwasu foliowego w ZD.
http://www.wikipathways.org/index.php/Pathway:WP241
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5042458/
https://www.ncbi.nlm.nih.gov/pubmed/22108709
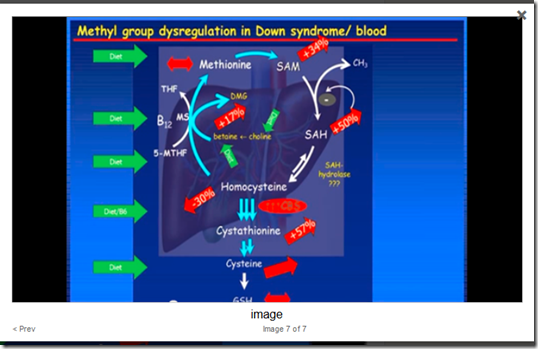
*nie zwrócono uwagi na proces naturalnej komepensacji via skrót metylowy, zaobserwowany przez dr.Rimę Obeidę
Zwraca ona na fakt, że tytułem nadmiernego zaburzenia CYKLU KWASU FOLIOWEGO, istotną rolę w metylacji przejęły cykl kobalaminy (witaminy B12) i przede wszystkim właśnie skrót metylacyjny. Jak widać na wykresie oba procesy są wyraźnie silniejsze.
2.JAKIE POLIMORFIZMY METYLACYJNE NALEŻY UWZGLĘDNIĆ W PRZYGOTOWANYM SPERSONALIZOWANYM PODEJŚCIU DO DZIECKA Z ZD.
W raporcie uwzględniono polimorfizmy MTHFR C77T, MTHFR A1298C, MTR A2756G, MTRR A66G. Jednak dzisiaj już wiemy, że jest to istotnie za mało i obraz metylacji opierający się tylko na tych polimorfizmach jest dalece nieprawidłowy. Czytając wyniki jakie prezentowane są w badaniu, widać odchylenie od tego co pokazują inni badacze po 2010 roku, a którzy wskazują na podstawę badawczą jako trisomię 21 bez polimorfizmów. Przy takim ujęciu ZD warunkuje poziom homocysteiny w wartościach 5,2 μmol/l +/- 0,5.
Przypomnę, że inne kluczowe geny/polimorfizmy to FOLR, DHFR, MTHFD, SHMPT przy cyklu kwasu foliowego, FUT2, TCN przy cyklu kobalaminy, DMGDG przy cyklu choliny, MAT przy cyklu metioniny.
Uwzględniając poszczególne polimorfizmy wartość homocysteiny może mieć istotny, zróżnicowany charakter od poziomu 3,2 μmol/l do 24 μmol/l.
Pozostaje w tej części jeszcze kilka pytań na które raport nie odpowiada, a po 2010 roku badacze istotnie poruszają:
-jakie jest zużycie poszczególnych witamin w momencie istotnej deregulacji całego procesu
-kwas foliowy, kobalamina, cholina to jedynie donory grupy metylowej zarządzane przez poszczególne geny, które wymagają określonych składników by działać. Zespół Downa jest w tym układzie problemem niedoborów i złego metabolizmu, zatem analiza metylacji bez analizy źródłowej w tym zakresie jest z góry zła…a tutaj pojawia się gen PSMG1 i problemy jelitowe, które zakłócają absorpcję poszczególnych składników.
-zatem czy biorąc pod uwagę powyższe elementy możemy zadać następujące pytania: czy analizowane poziomy nie są z góry złym punktem odniesienia, gdyż w ZD potrzebujemy pewnych substancji inaczej niż to mówią grupy kontrolne bez ZD? może to co widzimy to obraz ukrytych niedoborów, gdyż metabolizm jest istotnie trudniejszy tytułem problemów z mitochondriami w ZD, a co oznacza z brakiem energii koniecznej do przeprowadzenia tych wszystkich procesów?
3.POLIMORFIZMY A FORMY CHEMICZNE SUBSTANCJI WSPOMAGAJACYCH METYLACJĘ
Analiza metylacji w oparciu o cyjanokobalaminę, kwas foliowy syntetyczny w przypadku ZD jest oparta o założenie, że akceptujemy jej niską skuteczność. Jeżeli tak jest to nie dziwi w tym badaniu to, że efekt suplementacji osiągnięto jedynie dzięki suplementacji połączonej dodatkowo z witaminą B6. Z perspektywy moich doświadczeń wynika, że zmiana formy na metylową w kontekście witaminy B12 i witaminy B9 oraz uzupełnienie tego zestawu o niemalże wszystkie witaminy z grupy B plus cynk, magnez i cholinę daje niesamowite i bardzo szybkie zmiany poziomów analizowanych tutaj parametrów, które zachowują się krańcowo inaczej w takiej sytuacji.
Z drugiej strony należy uwzględnić geograficzną typologie pewnych polimorfizmów. Z mojego doświadczenia wynika wyższa obecność w Polsce polimorfizmu MTHFR A1298C od MTHFR C677T, która to dodatkowo obniża miano homocysteiny i to w znaczący sposób w stosunku do tego drugiego polimorfizmu, a który może być dominujący we Francji. Brak tego typu analizy szczegółowej powoduje, że ten raport znów nie może odgrywać istotnej roli.
Inna kwestią jest typologia występowania danych polimorfizmów w stosunku do nacji. U Polaków z mojego doświadczenia mamy istotne problemy z polimorfizmami związanymi z cyklem witaminy B12 bardziej niż kwasu foliowego, co może także dramatycznie obniżyć istotność cyklu kobalaminy w ZD, gdy w Brazylii podobna sytuacja ma z polimorfizmami genu BHMT.
Ponieważ metylacja ma charakter epigenetyczny, zatem taka środowiskowa adjustacja wyników powinna być brana pod uwagę i uwzględniać lokalne, środowiskowe czynniki i typologie, które mogą inaczej kreować procesy metaboliczne. Z tej perspektywy patrząc nie zachowano tutaj tej poprawności i adjustacji.
PODSUMOWUJĄC zatem wszystkie te rozważania, mogę napisać że badania na temat ZD i polimorfizmów są, ale są “stare”, nieprecyzyjne i wymagają istotnej korekty. Wiemy dziś, że metylacja ma istotnie rozchwiany charakter w ZD, co oznacza hypometylację w jednym przypadku, gdy w drugim mamy hipermetylację. Wiemy, także że polimorfizmy rodzinne przekładają się na funkcjonowanie osoby z ZD. mamy bazę…ale czy my rodzice chcemy z niej skorzystać i czy do niej jesteśmy przekonani to już inna kwestia. Dla mnie proces regulacji metylacji wydaje się być najłatwiejszym działaniem jakie może podjąć rodzic w układzie dietetycznym i suplementacyjnym, co może dać poprawę funkcjonowania jego dziecka i to jest jego decyzja, czy rodzic podejmie taką próbę, czy też nie…a wiedza jest.